Legislación
Aquí encontrarás todos los reglamentos que regulan los ensayos clínicos e investigaciones, pero si tienes cualquier duda:
Un Ensayo clínico es toda investigación relativa a personas destinada a: a) descubrir o comprobar los efectos clínicos, farmacológicos o demás efectos farmacodinámicos de uno o más medicamentos; b) identificar cualquier reacción adversa a uno o más medicamentos, o c) estudiar la absorción, la distribución, el metabolismo y la excreción de uno o más medicamentos, con el objetivo de determinar la seguridad y/o eficacia de dichos medicamentos.
Sólo se podrá iniciar un ensayo clínico cuando el Comité Ético de Investigación Clínica que corresponda y la Agencia Española de Medicamentos y Productos Sanitarios hayan considerado que los beneficios esperados para el sujeto del ensayo y para la sociedad justifican los riesgos; asimismo, sólo podrá proseguir si se supervisa permanentemente el cumplimiento de este criterio.
Los ensayos clínicos se realizarán en condiciones de respeto a los derechos del sujeto y a los postulados éticos que afectan a la investigación biomédica con seres humanos. En particular, se deberá salvaguardar la integridad física y mental del sujeto, así como su intimidad y la protección de sus datos, de acuerdo con la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos y Garantía de los Derechos Digitales. Se obtendrá y documentará el consentimiento informado de cada uno de los sujetos del ensayo, libremente expresado, antes de su inclusión en el ensayo en los términos previstos en el artículo 7 de este real decreto.
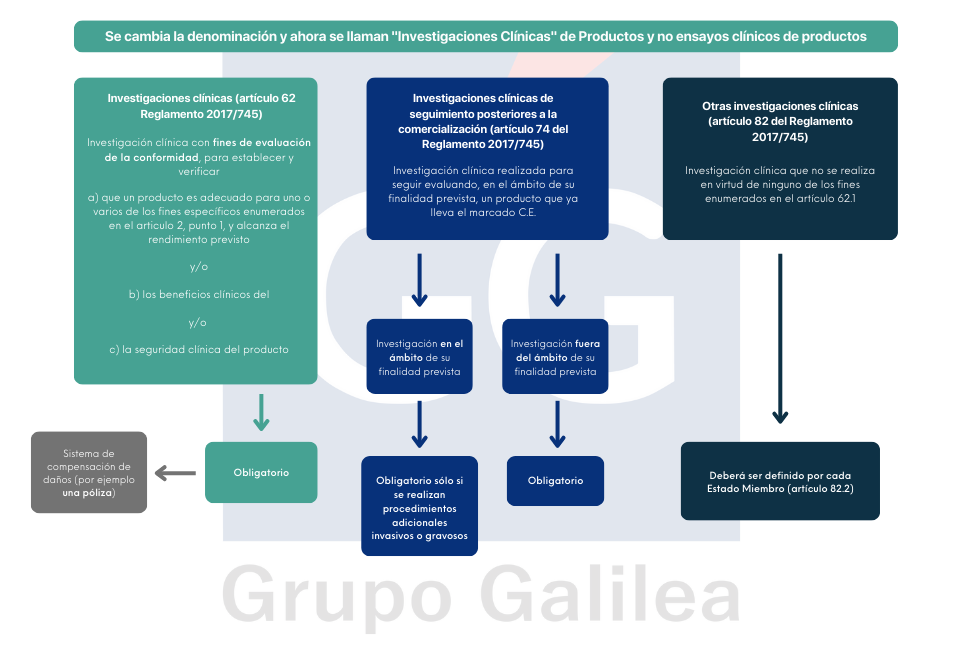
Sólo podrá realizarse un ensayo clínico con medicamentos en investigación si, previamente, se ha concertado un seguro u otra garantía financiera que cubra los daños y perjuicios que como consecuencia del ensayo puedan resultar para la persona en que hubiera de realizarse, salvo que el ensayo se refiera únicamente a medicamentos autorizados en España, su utilización en el ensayo se ajuste a las condiciones de uso autorizadas y el Comité Ético de Investigación Clínica considere que las intervenciones a las que serán sometidos los sujetos por su participación en el ensayo suponen un riesgo equivalente o inferior al que correspondería a su atención en la práctica clínica habitual.
El promotor del ensayo es el responsable de la contratación de dicho seguro de responsabilidad o de la garantía financiera y éstos cubrirán las responsabilidades del promotor, del investigador principal y sus colaboradores, y del hospital o centro donde se lleve a cabo el ensayo clínico.
Consideraciones importantes:
“Artículo 9. Indemnización por daños y perjuicios.
- En los ensayos clínicos distintos de los «ensayos clínicos de bajo nivel de intervención» el promotor velará para que el sujeto de ensayo sea indemnizado por los eventuales daños y perjuicios sufridos como consecuencia del ensayo. Esta indemnización será independiente de la capacidad financiera del promotor, del investigador y del centro.
- El promotor del ensayo es el responsable de que se haya contratado un seguro o garantía financiera que cubra los daños y perjuicios señalados en el apartado 1, al mismo tiempo que las responsabilidades en que pudieran incurrir el promotor, el investigador principal y sus colaboradores, incluyendo a los investigadores clínicos contratados, y el hospital o centro donde se lleve a cabo el ensayo clínico, lo cual deberá documentar previamente a la realización del ensayo, salvo que se trate de «ensayos clínicos de bajo nivel de intervención».
- En el caso de ensayos clínicos encuadrados dentro de la definición de «investigación clínica sin ánimo comercial» se podrá presentar una solicitud sin haber contratado el seguro o garantía financiera a que hace referencia el apartado 2. Sin embargo, en caso de ser favorable el dictamen del CEIm, la resolución de autorización quedará supeditada a la presentación de dicha documentación al propio CEIm en un plazo de treinta días naturales no pudiendo iniciarse el estudio hasta que este considere que se cuenta con el seguro o garantía financiera exigidos.
- Los daños y perjuicios sobre el sujeto de estudio que pudieran resultar como consecuencia de un ensayo clínico de bajo nivel de intervención no precisarán estar cubiertos por un contrato de seguro o garantía financiera a los que se refiere el apartado 2 si los mismos estuvieran cubiertos por el seguro de responsabilidad civil profesional individual o colectivo o garantía financiera equivalente del centro sanitario donde se lleve a cabo el ensayo clínico.»
- …»
Artículo 10. Régimen de responsabilidad.
- Se presume, salvo prueba en contrario, que los daños que afecten a la salud del sujeto del ensayo durante su realización y en el año siguiente a la finalización del tratamiento se han producido como consecuencia del ensayo. Sin embargo, una vez concluido el año, el sujeto del ensayo está obligado a probar el nexo entre el ensayo y el daño producido.
- A los efectos del régimen de responsabilidad previsto en este artículo, serán objeto de resarcimiento todos los gastos derivados del menoscabo en la salud o estado físico de la persona sometida al ensayo clínico, así como los perjuicios económicos que se deriven directamente de dicho menoscabo, siempre que este no sea inherente a la patología objeto de estudio o a la evolución propia de su enfermedad como consecuencia de la ineficacia del tratamiento.
- El importe mínimo que se garantizará en concepto de responsabilidad será de 250.000 euros por persona sometida a ensayo clínico, pudiendo ser percibido en forma de indemnización a tanto alzado o de renta equivalente al mismo capital. Podrá establecerse un capital asegurado máximo o importe máximo de la garantía financiera por ensayo clínico y anualidad de 2.500.000 euros.
Este Reglamento, de plena aplicación desde el 26 de mayo de 2021, establece unas normas relativas a la introducción en el mercado, la comercialización o la puesta en servicio de productos sanitarios para uso humano y accesorios de dichos productos en la Unión Europea, aplicándose a las investigaciones clínicas relativas a los productos sanitarios y accesorios que se llevan a cabo en la Unión. El Reglamento también es de aplicación a los productos que no persiguen fines médicos.
La realización de una investigación que comporte un procedimiento invasivo en seres humanos exigirá el aseguramiento previo de los daños y perjuicios que pudieran derivarse de aquélla para la persona en la que se lleve a efecto.
Investigación Biomédica: Investigación desarrollada mediante protocolos que incluyen procedimientos de obtención y aplicación de células y tejidos humanos en humanos, cuando la eficacia o seguridad de los procedimientos o de las células o tejidos no están suficientemente comprobadas o cuando la aplicación terapéutica no está suficientemente consolidada, y cuya finalidad es la comprobación de alguno de estos puntos
Artículo 18 de la Ley 14/2007, de 3 de julio Investigación biomédica: Consideraciones importantes
- Las personas que hayan sufrido daños como consecuencia de su participación en un proyecto de investigación, recibirán la compensación que corresponda, de acuerdo con lo establecido en los apartados siguientes.
- La realización de una investigación que comporte un procedimiento invasivo en seres humanos exigirá el aseguramiento previo de los daños y perjuicios que pudieran derivarse de aquella para la persona en la que se lleve a efecto.
- Cuando, por cualquier circunstancia, el seguro no cubra enteramente los daños causados, el promotor de la investigación, el investigador responsable de la misma y el hospital o centro en el que se hubiere realizado responderán solidariamente de aquellos, aunque no medie culpa, incumbiéndoles la carga de la prueba. Ni la autorización administrativa ni el informe del Comité de Ética de la Investigación les eximirán de la responsabilidad.
- Se presume, salvo prueba en contrario, que los daños que afecten a la salud de la persona sujeta a la investigación, durante su realización y en el año siguiente a su terminación, se han producido como consecuencia de la investigación. Sin embargo, una vez concluido el año, el sujeto de aquella estará obligado a probar el daño y el nexo entre la investigación y el daño producido.
- En los demás aspectos relativos a la responsabilidad por daños y a su aseguramiento se aplicará lo dispuesto en la legislación sobre garantías y uso racional de medicamentos y productos sanitarios.”
- Orientada en beneficio de la salud
- La protección de la dignidad e identidad del ser humano, así como la protección de la salud del donante
- El consentimiento y el derecho a la información
- La protección de datos personales y el deber de confidencialidad
- La no discriminación
- La libertad de investigación y producción científica
- La evaluación científica como presupuesto para la ejecución de la investigación biomédica
- La coordinación de esfuerzos de actores públicos y privados